Histona H1
| Histona ligadora H1 y familia H5 | ||
|---|---|---|
 | ||
| Identificadores | ||
| Símbolo | Histona ligadora | |
| Pfam | PF00538 | |
| InterPro | IPR005818 | |
| SMART | SM00526 | |
| SCOP | 1hst | |
La histona H1 es una de las cinco familias principales de proteínas histonas, las cuales son componentes de la cromatina dentro de los núcleos de las células eucariotas. Aunque está altamente conservada evolutivamente, la histona H1 es la histona con la secuencia más variable entre especies.
Estructura
[editar]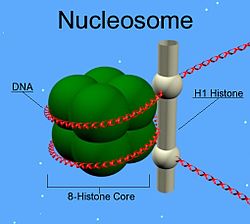
Muchas de las proteínas H1 de metazoos incluyen un centro globular con un dominio en "hélice alada" y extremos C- y N-terminal largos. H1 está involucrada en el empaquetamiento de las subestructuras en forma de "cuentas en cuerda" en una estructura de orden superior, cuyos detalles aún no se han resuelto.[1] Las proteínas H1 en organismos protistas y bacterias, denominadas como nucleoproteínas HC1 y HC2 (Pfam PF07432, PF07382), no tienen ni el dominio central ni la cola del extremo N-terminal.[2]
La histona H1 está menos conservada evolutivamente que otras histonas, siendo su dominio globular la parte más conservada.[3]
Función
[editar]A diferencia de otras histonas, H1 no forma parte de la estructura en "cuenta" de los nucleosomas. Se sitúa encima de estos, manteniendo estable el ADN que se encuentra envolviendo el nucleosoma. Los niveles de H1 son 50% menores respecto a los de las otras cuatro histonas, las cuales contribuyen en pares a la estructura del nucleosoma. Además de unirse a este, la proteína H1 se une al ADN espaciador, una región del ADN de longitud, aproximadamente, de 20-80 nucleótidos y situada entre cada nucleosoma. Esto ayuda a la estabilidad de la fibra en zig-zag de 30 nanómetros (nm) de la cromatina.[4] Estudios sobre las fibras de cromatina purificadas han permitido conocer más en detalle la histona H1. La extracción iónica de H1 de la cromatina promueve su desempaquetamiento en condiciones hipotónicas de las fibras de 30 nm de ancho hasta formar matrices de nucleosomas en forma de perlas.[5][6][7]
No se sabe si la histona H1 promueve la formación de fibras de cromatina en solenoide, en las que el ADN espaciador expuesto es más corto, o si tan solo promueve un cambio en el ángulo de los nucleosomas adyacentes sin afectar a la longitud del ADN espaciador.[8] Sin embargo, se ha comprobado que las histonas ligadoras dirigen el empaquetamiento de las fibras de cromatina que se han reconstituido in vitro utilizando matrices de ADN sintético del elemento fuerte '601' de los nucleosomas.[9] Los experimentos de interacciones ADN-proteínas y de digestión por nucleasas sugieren que el dominio globular de la histona H1 se posiciona cerca de la díada del nucleosoma, donde se oculta una longitud de 15-30 bp de ADN adicional.[10][11][12][13] Además, experimentos con cromatina reconstituida indican que existe un motivo de secuencia característico en la díada en presencia de H1.[14] A pesar de las lagunas en el conocimiento sobre la proteína H1, se ha planteado un modelo general de cómo el dominio globular de H1 cierra el nucleosoma al entrecruzar el ADN entrante y saliente, mientras que la cola se une al ADN espaciador y neutraliza su carga negativa.[8][12]
Múltiples experimentos sobre la función de H1 se han desarrollado en cromatina procesada y purificada en condiciones hipotónicas, pero el rol de H1 in vivo está menos claro. Estudios celulares han mostrado que la sobreexpresión de H1 puede generar morfologías aberrantes en el núcleo celular y la estructura de la cromatina, y que H1 puede servir tanto como regulador negativo como positivo de la regulación transcripcional, dependiendo del gen.[15][16][17] En extractos de óvulos de Xenopus, la deleción de H1 causa una duplicación, aproximadamente, de la extensión de los cromosomas mitóticos, mientras que la sobreexpresión causa que los cromosomas se hiper-compacten en una masa inseparable.[18][19] La desactivación completa de H1 in vivo no ha sido posible en organismos multicelulares debido a la existencia de múltiples isoformas que pueden estar presentes en grupos de diferentes genes. Sin embargo, diferentes isoformas de histonas ligadoras han sido delecionadas en Tetrahymena, C. elegans, Arabidposis, Drosophila, y ratón, resultando en múltiples defectos específicos de organismo en la morfología nuclear, estructura de la cromatina, metilación del ADN y/o expresión génica específica.[20][21][22]
Dinámica
[editar]Aunque la mayoría de las histonas H1 en el núcleo celular se unen a la cromatina, estas se desplazan entre diferentes regiones de la cromatina a una velocidad bastante alta.[23][24]
Esto plantea dificultades para comprender cómo una proteína tan dinámica podría ser un componente estructural de la cromatina, aunque se ha sugerido que el equilibrio estacionario en el núcleo sigue favoreciendo fuertemente la asociación entre H1 y la cromatina, implicando que a pesar de esta dinámica, la mayoría de H1 está unida a la cromatina en todo momento.[25] H1 compacta y estabiliza el ADN durante el empaquetamiento de la cromatina, lo que sugiere que la unión dinámica de H1 puede proveer protección al ADN en situaciones en las que los nucleosomas tienen que ser retirados.[26]
Los factores citoplasmáticos parecen ser necesarios para el intercambio dinámico de la histona H1 en la cromatina, pero aún tienen que ser identificadas de manera específica.[27] La dinámica de H1 puede estar mediada, hasta cierto grado, por modificaciones como la O-glicosilación y la fosforilación. La O-glicosilación de H1 puede promover la condensación de la cromatina. Se ha comprobado que la fosforilación durante la interfase disminuye la afinidad de H1 por la cromatina y puede promover el desempaquetamiento de la cromatina y transcripción activa. Sin embargo, la fosforilación durante la mitosis incrementa la afinidad de H1 por los cromosomas, promoviendo su condensación.[19]
Isoformas
[editar]La familia de proteínas H1 en animales incluye múltiples isoformas de H1 que se pueden expresar en tejidos y estadios del desarrollo diferentes o solapantes en un mismo organismo. Se desconoce la razón de la existencia de estas múltiples isoformas, pero tanto su conservación evolutiva desde los erizos de mar hasta los humanos como las diferencias significativas entre sus secuencias sugieren que no son funcionalmente equivalentes.[28][29][3] Una de estas isoformas es la histona H5, la cual se encuentra en eritrocitos de aves, los cuales son diferentes a los eritrocitos de mamíferos en que sí tienen núcleo. Otra isoforma es H1M (también llamada B4 y H1foo), en ovocitos/zigotos de erizos de mar, ranas, ratón y humano, la cual es reemplazada en el embrión por las isoformas somáticas H1A-E y H10, similares a H5.[3][30][31][32] A pesar de tener más cargas negativas que las isoformas negativas, H1M se une con una mayor afinidad a cromosomas mitóticos en extractos de ovocitos de Xenopus.[19]
Modificaciones postraduccionales
[editar]De manera similar a otras histonas, la familia de proteínas H1 recibe extensas modificaciones postraduccionales (PTMs). Esto incluye fosforilación de serina y treonina, acetilación de lisina, metilación de lisina y ubiquitinización.[33] Estas modificaciones tienen una variedad de funciones pero están menos estudiadas que las modificaciones postraduccionales en otras histonas.
Véase también
[editar]- Nucleosoma
- Histona
- Cromatina
- Variantes de la histona ligadora H1
- Otras proteínas histonas involucradas en la cromatina:
Referencias
[editar]- ↑ Ramakrishnan V.; Finch J.T.; Graziano V.; Lee P.L.; Sweet R.M.; Finch J.T.; Graziano V. ; Lee P.L. ; Sweet R.M. (Marzo de 1993). «Crystal structure of globular domain of histone H5 and its implications for nucleosome binding». Nature 362 (6417): 219-223. Bibcode:1993Natur.362..219R. PMID 8384699. doi:10.1038/362219a0. Consultado el 23 de septiembre de 2022.
- ↑ Kasinsky, Harold E; Lewis, John D; Dacks, Joel B; Ausló, Juan (Enero de 2001). «Origin of H1 linker histones». FASEB Journal 15 (1): 34-42. PMID 11149891. doi:10.1096/fj.00-0237rev. Consultado el 23 de septiembre de 2022.
- ↑ a b c Izzo, Annalisa; Kamieniarz, Kinga; Schneider, Robert (Abril de 2008). «The histone H1 family: specific members, specific functions?». Biological Chemistry 389 (4): 333-43. PMID 18208346. doi:10.1515/BC.2008.037. Consultado el 23 de septiembre de 2022.
- ↑ Jeon, Kwang W. apellidos2=Berezney (1995). Structural and functional organization of the nuclear matrix. Boston: Academic Press. p. 623. ISBN 978-0-12-364565-4. Consultado el 23 de septiembre de 2022.
- ↑ Finch, J.T.; Klug, A. (Junio de 1976). «Solenoidal model for superstructure in chromatin». Proceedings of the National Academy of Sciences of the United States of America 73 (6): 1897-901. Bibcode:1976PNAS...73.1897F. PMC 430414. PMID 1064861. doi:10.1073/pnas.73.6.1897. Consultado el 23 de septiembre de 2022.
- ↑ Thoma, F.; Koller, T. (Septiembre de 1977). «Influence of histone H1 on chromatin structure». Cell 12 (1): 101-7. PMID 561660. doi:10.1016/0092-8674(77)90188-X. Consultado el 23 de septiembre de 2022.
- ↑ Thoma, F.; Koller, T.; Klug, A (Noviembre de 1979). «Involvement of histone H1 in the organization of the nucleosome and of the salt-dependent superstructures of chromatin». The Journal of Cell Biology 83 (2 Pt 1): 403-27. PMC 2111545. PMID 387806. doi:10.1083/jcb.83.2.403. Consultado el 23 de septiembre de 2022.
- ↑ a b van Holde, K.; Zlatanova, J. (Octubre de 1996). «What determines the folding of the chromatin fiber?». Proceedings of the National Academy of Sciences of the United States of America 93 (20): 10548-55. Bibcode:1996PNAS...9310548V. PMC 38190. PMID 8855215. doi:10.1073/pnas.93.20.10548. Consultado el 23 de septiembre de 2022.
- ↑ «Nucleosome repeat length and linker histone stoichiometry determine chromatin fiber structure». Proceedings of the National Academy of Sciences of the United States of America 105 (26): 8872-7. Julio 2008. Bibcode:2008PNAS..105.8872R. PMC 2440727. PMID 18583476. doi:10.1073/pnas.0802336105. Consultado el 23 de septiembre de 2022.
- ↑ Varshavsky, A. J.; Bakayev, V. V.; Georgiev, G. P. (Febrero de 1976). «Heterogeneity of chromatin subunits in vitro and location of histone H1». Nucleic Acids Research 3 (2): 477-92. PMC 342917. PMID 1257057. doi:10.1093/nar/3.2.477. Consultado el 23 de septiembre de 2022.
- ↑ Whitlock, J. P.; Simpson, R. T. (Julio de 1976). «Removal of histone H1 exposes a fifty base pair DNA segment between nucleosomes». Biochemistry 15 (15): 3307-14. PMID 952859. doi:10.1021/bi00660a022. Consultado el 23 de septiembre de 2022.
- ↑ a b Allan, J.; Hartman, P. G.; Crane-Robinson, C.; Aviles, F. X. (Diciembre de 1980). «The structure of histone H1 and its location in chromatin». Nature 288 (5792): 675-9. Bibcode:1980Natur.288..675A. PMID 7453800. doi:10.1038/288675a0. Consultado el 23 de septiembre de 2022.
- ↑ Staynov, D. Z.; Crane-Robinson, C. (Diciembre de 1988). «Footprinting of linker histones H5 and H1 on the nucleosome». The EMBO Journal 7 (12): 3685-91. PMC 454941. PMID 3208745. doi:10.1002/j.1460-2075.1988.tb03250.x. Consultado el 23 de septiembre de 2022.
- ↑ Bednar, Jan; Horowitz, Rachel A.; Grigoryev, Sergei A.; Carruthers, Lenny M.; Hansen, Jeffrey C.; Koster, Abraham J.; Woodcock, Christopher L. (Noviembre de 1998). «Nucleosomes, linker DNA, and linker histone form a unique structural motif that directs the higher-order folding and compaction of chromatin». Proceedings of the National Academy of Sciences of the United States of America 95 (24): 14173-8. Bibcode:1998PNAS...9514173B. PMC 24346. PMID 9826673. doi:10.1073/pnas.95.24.14173. Consultado el 23 de septiembre de 2022.
- ↑ Dworkin-Rastl, Eva; Kandolf, Harald; Smith, Rosamund C. (Febrero de 1994). «The maternal histone H1 variant, H1M (B4 protein), is the predominant H1 histone in Xenopus pregastrula embryos». Developmental Biology 161 (2): 425-39. PMID 8313993. doi:10.1006/dbio.1994.1042. Consultado el 23 de septiembre de 2022.
- ↑ Brown, D. T.; Alexander, B. T.; Sittman, D. B. (Febrero de 1996). «Differential effect of H1 variant overexpression on cell cycle progression and gene expression». Nucleic Acids Research 24 (3): 486-93. PMC 145659. PMID 8602362. doi:10.1093/nar/24.3.486. Consultado el 23 de septiembre de 2022.
- ↑ Gunjan, Akash; Alexander, Barbara T.; Sittman, Donald B.; Brown, David T. (Diciembre de 1999). «Effects of H1 histone variant overexpression on chromatin structure». The Journal of Biological Chemistry 274 (53): 37950-6. PMID 10608862. doi:10.1074/jbc.274.53.37950. Consultado el 23 de septiembre de 2022.
- ↑ Maresca, Thomas J.; Freedman, Benjamin S.; Heald, Rebecca (Junio de 2005). «Histone H1 is essential for mitotic chromosome architecture and segregation in Xenopus laevis egg extracts». The Journal of Cell Biology 169 (6): 859-69. PMC 2171634. PMID 15967810. doi:10.1083/jcb.200503031. Consultado el 23 de septiembre de 2022.
- ↑ a b c Freedman, Benjamin S.; Heald, Rebecca (Junio de 2010). «Functional comparison of H1 histones in Xenopus reveals isoform-specific regulation by Cdk1 and RanGTP». Current Biology 20 (11): 1048-52. PMC 2902237. PMID 20471264. doi:10.1016/j.cub.2010.04.025. Consultado el 23 de septiembre de 2022.
- ↑ Shen, Xuetong; Yu, Lanian; Weir, Joyce W.; Gorovsky, Martin A. (Julio de 1995). «Linker histones are not essential and affect chromatin condensation in vivo». Cell 82 (1): 47-56. PMID 7606784. doi:10.1016/0092-8674(95)90051-9. Consultado el 23 de septiembre de 2022.
- ↑ Jedrusik, M. A.; Schulze, E. (Abril de 2001). «A single histone H1 isoform (H1.1) is essential for chromatin silencing and germline development in Caenorhabditis elegans». Development 128 (7): 1069-80. PMID 11245572. doi:10.1242/dev.128.7.1069. Consultado el 23 de septiembre de 2022.
- ↑ Lu, Xingwu; Wontakal, Sandeep N.; Emelyanov, Alexander V.; Morcillo, Patrick; Konev, Alexander Y; Fyodorov, Dimitry V.; Skoultchi, Arthur I. (Febrero de 2009). «Linker histone H1 is essential for Drosophila development, the establishment of pericentric heterochromatin, and a normal polytene chromosome structure». Genes & Development 23 (4): 452-65. PMC 2648648. PMID 19196654. doi:10.1101/gad.1749309. Consultado el 23 de septiembre de 2022.
- ↑ Misteli, Tom; Gunjan, Akash; Hock, Robert; Bustin, Michael; Brown, David T. (Diciembre de 2000). «Dynamic binding of histone H1 to chromatin in living cells». Nature 408 (6814): 877-81. Bibcode:2000Natur.408..877M. PMID 11130729. doi:10.1038/35048610. Consultado el 23 de septiembre de 2022.
- ↑ Chen, Danyang; Dundr, Miroslav; Wang, Chen; Leung, Anthony; Lamond, Angus; Misteli, Tom; Huang, Sui (Enero de 2005). «Condensed mitotic chromatin is accessible to transcription factors and chromatin structural proteins». The Journal of Cell Biology 168 (1): 41-54. PMC 2171683. PMID 15623580. doi:10.1083/jcb.200407182. Consultado el 23 de septiembre de 2022.
- ↑ Bustin, MIchael; Catez, Frédéric; Lim, Jae-Hwan (Marzo de 2005). «The dynamics of histone H1 function in chromatin». Molecular Cell 17 (5): 617-20. PMID 15749012. doi:10.1016/j.molcel.2005.02.019. Consultado el 23 de septiembre de 2022.
- ↑ Xiao, Botao; Freedman, Benjamin S.; Miller, Kelly E.; Heald, Rebecca; Marko, John F. (Diciembre de 2012). «Histone H1 compacts DNA under force and during chromatin assembly». Molecular Biology of the Cell 23 (24): 4864-71. PMC 3521692. PMID 23097493. doi:10.1091/mbc.E12-07-0518. Consultado el 23 de septiembre de 2022.
- ↑ Freedman, Benjamin S.; Miller, Kelly E.; Heald, Rebecca (Septiembre de 2010). «Xenopus egg extracts increase dynamics of histone H1 on sperm chromatin». En Cimini, Daniela, ed. PLOS ONE 5 (9): e13111. Bibcode:2010PLoSO...513111F. PMC 2947519. PMID 20927327. doi:10.1371/journal.pone.0013111. Consultado el 23 de septiembre de 2022.
- ↑ Steinbach, Oliver C.; Wolffe, Alan P.; Rupp, Ralph A. W. (Septiembre de 1997). «Somatic linker histones cause loss of mesodermal competence in Xenopus». Nature 389 (6649): 395-9. Bibcode:1997Natur.389..395S. PMID 9311783. doi:10.1038/38755. Consultado el 23 de septiembre de 2022.
- ↑ De, Siddhartha; Brown, David T.; Lu, Zhi Hong; Leno, Gregory H; Wellman, Susan E.; Sittman, Donald B. (Junio de 2002). «Histone H1 variants differentially inhibit DNA replication through an affinity for chromatin mediated by their carboxyl-terminal domains». Gene 292 (1–2): 173-81. PMID 12119111. doi:10.1016/S0378-1119(02)00675-3. Consultado el 23 de septiembre de 2022.
- ↑ Khochbin, Saadi (Junio de 2001). «Histone H1 diversity: bridging regulatory signals to linker histone function». Gene 271 (1): 1-12. PMID 11410360. doi:10.1016/S0378-1119(01)00495-4. Consultado el 23 de septiembre de 2022.
- ↑ Godde, James S.; Ura, Kiyoe (Marzo de 2008). «Cracking the enigmatic linker histone code». Journal of Biochemistry 143 (3): 287-93. PMID 18234717. doi:10.1093/jb/mvn013. Consultado el 23 de septiembre de 2022.
- ↑ Happel, Nicole; Doenecke, Detlef (Febrero de 2009). «Histone H1 and its isoforms: contribution to chromatin structure and function». Gene 431 (1–2): 1-12. PMID 19059319. doi:10.1016/j.gene.2008.11.003. Consultado el 23 de septiembre de 2022.
- ↑ Harshman, Sean W.; Young, Nicolas L.; Parthun, Mark R.; Freiitas, Michael A. (Noviembre de 2013). «H1 histones: current perspectives and challenges». Nucleic Acids Research 41 (21): 9593-609. PMC 3834806. PMID 23945933. doi:10.1093/nar/gkt700. Consultado el 23 de septiembre de 2022.
